INEP - Química - 2010 - Exame Nacional do Ensino Médio - Primeiro e Segundo Dia - PPL
Devido ao seu alto teor de sais, a água do mar é imprópria para o consumo humano e para a maioria dos usos da água doce. No entanto, para a indústria, a água do mar é de grande interesse, uma vez que os sais presentes podem servir de matérias-primas importantes para diversos processos. Nesse contexto, devido a sua simplicidade e ao seu baixo potencial de impacto ambiental, o método da precipitação fracionada tem sido utilizado para a obtenção dos sais presentes na água do mar.
Tabela 1: Solubilidade em água de alguns compostos presentes na água do mar a 25
oC
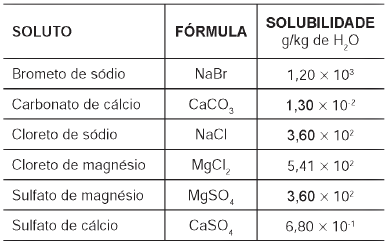
Pitombo, L.R.M.; Marcondes, M.E.R.; GEPEC. Grupo de pesquisa em Educação em Química.
Química e Sobrevivência: Hidrosfera Fonte de Materiais. São Paulo: EDUSP, 2005 (adaptado).
Suponha que uma indústria objetiva separar determinados sais de uma amostra de água do mar a 25 °C, por meio da precipitação fracionada. Se essa amostra contiver somente os sais destacados na tabela, a seguinte ordem de precipitação será verificada:
A) Carbonato de cálcio, sulfato de cálcio, cloreto de sódio e sulfato de magnésio, cloreto de magnésio e, por último, brometo de sódio.
B) Brometo de sódio, cloreto de magnésio, cloreto de sódio e sulfato de magnésio, sulfato de cálcio e, por último, carbonato de cálcio.
C) Cloreto de magnésio, sulfato de magnésio e cloreto de sódio, sulfato de cálcio, carbonato de cálcio e, por último, brometo de sódio.
D) Brometo de sódio, carbonato de cálcio, sulfato de cálcio, cloreto de sódio e sulfato de magnésio e, por último, cloreto de magnésio.
E) Cloreto de sódio, sulfato de magnésio, carbonato de cálcio, sulfato de cálcio, cloreto de magnésio e, por último, brometo de sódio.
A
B
C
D
E



